這個單元滿多重點的,以下所說的會考都考過:
物質的分類
純物質與混合物的差別
物質可分成「純物質」跟「混合物」兩大類:
◆ 純物質:又可分成「元素」及「化合物」
• 元素:單種類原子所組成,「不可」再用化學方法分離,如氧氣(O2)
• 化合物:多種類原子依固定比例所組成,可使用化學方法再分離,如水(H2O)
◆ 混合物:純物質依任意比例混合而成。
對於元素、化合物跟混合物的差別必須了解清楚,會考很愛考 !
物理和化學的變化與性質
物理變化就是「不產生新物質」,化學變化就是有「產生新物質」。而物理性質就是觀察物理變化而得,如熔點、沸點、密度…等。化學性質也是觀察化學變化而得,如酸鹼性、腐蝕性…等。
物理變化的例子有「水的三態變化」,其實就是分子跟分子之間的距離改變,不產生新物質!
但是化學變化的話,例如光合作用,二氧化碳加水,被植物吸收,經過太陽光照,生成糖跟氧氣,這個就有產生新物質,因為反應物跟生成物是不一樣的物質,簡單來說,就是化學變化會產生新物質!
請把底下這張表格記起來,會考也很愛考 :

混合物的分離
混合物的分離,基本上是以其中各個純物質的物理性質不同來分離,例如溶解度,顆粒大小,熔、沸點…等性質來分離各個純物質。這個部分可以參考我的視頻講解,很愛考,112年會考才剛考過!
這個是重點喔,因為可以結合化學反應跟物理性質的觀念,所以會考也考好幾次了 !
水溶液
接下來進入到「溶液」的部分:
溶液的定義
◆ 溶液 = 溶質 + 溶劑 → (舉例:食鹽水 = 食鹽 + 水)
水溶液跟非水溶液的差別
◆ 水溶液就是「溶劑是水」,例如食鹽水。
◆ 非水溶液就是「溶劑不是水」,例如碘酒。
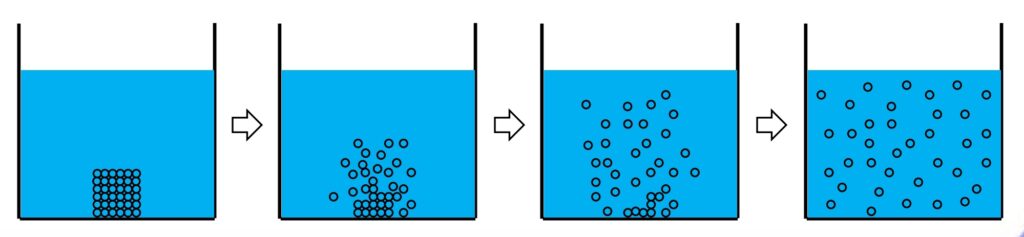
擴散現象
◆ 擴散現象就是溶質溶於溶劑後,溶解過程是由「高濃度往低濃度」的地方的地方擴散。
基本上,當溫度越高,擴散速率越快,因為溶質的粒子因「溫度越高,動能越大」。
溶液的濃度公式
這個非常重要,必定要會!其實滿簡單的。
◆ 重量百分濃度,就是溶質質量 / 溶液質量
◆ 體積百分濃度,就是溶質體積 / 溶液體積

溶解度的定義
◆ 簡單來說,溶解度就是在特定溫度及壓力下,100克的溶劑最多可以溶解多少溶質,如果以公式表示的話,就是:
「溶質能被溶解的最大克數 / 100克溶劑」
溶解度可以轉換成重量百分比濃度(反正溶液各種濃度表示,只要資訊給的夠,是可以互相轉換的)。
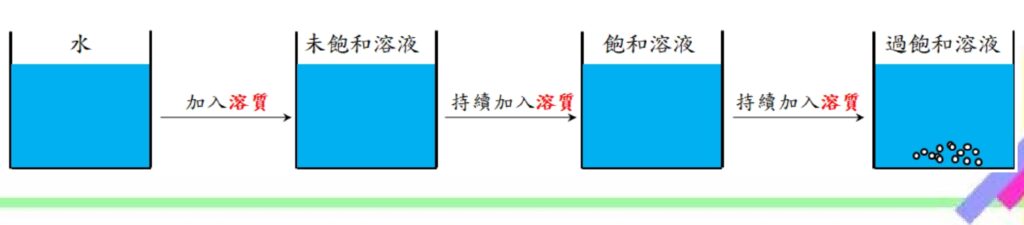
未飽和、飽和和過飽和溶液的定義
在特定溫度及壓力下:
◆ 未飽和溶液就是沒有達到溶解度,沒有沉澱產生。
◆ 飽和溶液就是剛好達到溶解度,沒有沉澱產生。
◆ 過飽和溶液就是超過溶解度,有沉澱產生。
圖示說明如下:
關於水溶液的題目,就是把重量百分比濃度、體積百分比濃度及溶解度都搞懂,多練習題目,就會開竅了,這個重點程度 ★★★★★
空氣的性質與用途
常見氣體的性質跟用途
◆ 請把固定氣體、非固定氣體的定義搞清楚,再來則是各個常見氣體的性質與用途記熟,記憶的部分就只能靠你們自己啦😂(會考都考的滿基本的,考到根本賺到!)

氣體收集的方法
再來是排水集氣法、向上排空氣法跟向下排空氣法。
◆「難溶於水」的氣體適用於排水集氣法(難溶於水才能用水來收集),那有二氧化碳,氧氣,氫氣跟氮氣…等。裝置的部分要注意瓶口塞跟管子的位置(這個會考最近才考過喔!)
◆「易溶於水」的氣體則用向上或向下排空氣法,那就是看待收集氣體與空氣的密度比較
– 密度比空氣大,就用向下排空氣法,如氯氣
– 密度比空氣小,就用向上排空氣法,如氨氣
以上就是單元二的重點😆
有理化問題歡迎寄信給我
