元素符號與常見的元素
物質的分類
這邊要在複習一下物質的分類,這個部分單元 2 提過喔 !
物質可分成「純物質」跟「混合物」兩大類:
◆ 純物質:又可分成「元素」及「化合物」
• 元素:單種類原子所組成,「不可」再用化學方法分離,如氧氣(O2)
• 化合物:多種類原子依固定比例所組成,可使用化學方法再分離,如水(H2O)
◆ 混合物:純物質依任意比例混合而成。
元素符號的命名
在所有元素中,我們可以分成兩類,『金屬元素』跟『非金屬元素』。
金屬元素 :
◆ 金屬固態元素的部首是『金』。例如 : 鎂(Mg)、鈉(Na)… 等。
◆ 金屬液態元素的部首是『水』。例如唯一的液態金屬汞(Hg)。
◆ 沒有氣態金屬喔 !
非金屬元素 :
◆ 非金屬固態元素的部首是『石』。例如 : 碳(C)、硫(S)… 等。
◆ 非金屬液態元素的部首是『水』。例如唯一的液態非金屬溴(Br)。
◆ 非金屬氣態元素的部首是『气』。例如 : 氧(O)、氮(N)… 等。
這邊要記一下兩個唯一,第一個唯一是液態金屬汞,第二個唯一是液態非金屬溴。
金屬與非金屬元素的性質比較
這個部份很好理解,因為金屬跟非金屬元素的性質是相反的,所以只要記一個就好 !
金屬性質 :
◆ 導電性良好
◆ 延展性良好
◆ 導熱性良好
◆ 顏色較單一性,幾乎都是銀色。但也有例外,例如金(黃色)、銅(紅色)。那非金屬的顏色就比較多元,例如碘(紫色)、溴(紅色)、碳(黑色)… 等。
生活中常見的元素
這裡就很偏”記憶”啦 ! 詳細的內容可參考視頻講解。但考試比較喜歡做整合比較,所以底下就幫你們做了一份表格整理 :

原子的世界
道耳吞的原子說
道耳吞提出關於原子的理論,有四項,但其中有些理論是被後面的科學家推翻,所以必須做出修改。
◆ 物質是由不可分割的原子所組成。( 道耳吞這邊的意思是說,原子是組成物質的最小粒子,但其實不是,因為原子中包含有電子、質子和中子,所以並不是最小粒子 ! )
◆ 相同原子的重量及性質相同。( 這條也是需要被修改的,因為有同位素的存在,所以重量會不同。)
◆ 不同種類的原子能以固定比例結合成化合物。
◆ 化學變化就是原子的重新排列組合產生成新物質。反應過程中,原子的種類及原子的總數目不改變。(這句話就是道耳吞原子說的精華,化學反應的真諦 ! 但是只有一種化學反應例外,就是核反應,所以除了核反應之外,其他所有的化學反應都是遵守這條理論的喔 ! )
亞弗加厥分子說
分子很重要喔 ! 因為分子是表現出物質特性的最小粒子。
分子種類
分子是由『同種類』或『不同種類』以特定比例組合而成。簡單來說,分子可分為元素跟化合物 !
◆ 同種類組成的叫做『元素』,例如 : 氧氣(O2)、臭氧(O3)、氮氣(N2) … 等。
◆ 不同種類組成的叫做『化合物』,例如 : 二氧化碳(CO2)、水(H2O)… 等。
簡單來說,分子可分為『元素』跟『化合物』 !
定比定律
定比定律的定義是『組成化合物的元素質量比是固定的』。簡單來說,以二氧化碳(CO2)為例 :
二氧化碳中的 C : O 總質量比是 3 : 8。
那它的原理是什麼 ?
Ans : 是由道耳吞原子說『不同種類的原子能以固定比例結合成化合物』。
那怎麼算的 ?
Ans : (碳的原子量 x 個數) : (氧的原子量 x 個數) = (12 x 1) : (16 x 2) = 3 : 8。
這個部分可以參考我的視頻講解。
原子結構
原子的結構是長的如下圖 :
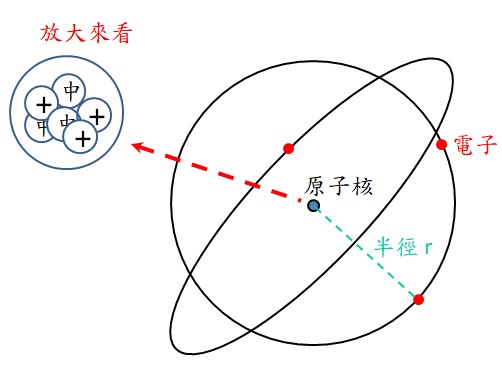
◆ 原子核在原子的中心,原子核內包含有質子跟中子。
◆ 電子被質子吸引而游移在原子的外圍,電子到原子核的距離就是原子的半徑。
質子、中子跟電子的性質
◆ 質子帶正電,電子帶負電,中子不帶電。
◆ 質子跟電子的電量相同但電性相反。
◆ 質子跟中子的質量幾乎一樣且遠大於電子。所以原子的重量幾乎集中於原子核。
原子序與質量數
◆ 原子序就是原子在元素週期表的位置(地址)。
◆ 質量數就幾乎等於是原子的質量。
原子序與質量數的公式
◆ 原子序 = 質子數 = 電子數。
◆ 質量數 = 質子數 + 中子數。
同位素
同位素就是原子序相同,而質量數不同的原子。簡單來說,就是有兩個原子,他們的原子序相同,所以他們在元素週期表的位置相同,也代表他們的質子數相同,但是他們的質量數不同,所以代表什麼 ? 代表他們的中子數不同。
離子
◆ 當原子失去電子,會形成負離子。
◆ 當原子得到電子,會形成正離子。
( 備註 : 原子中,只有電子可以移動,質子是不可以移動的 ! )
元素的分類與週期表
元素週期表
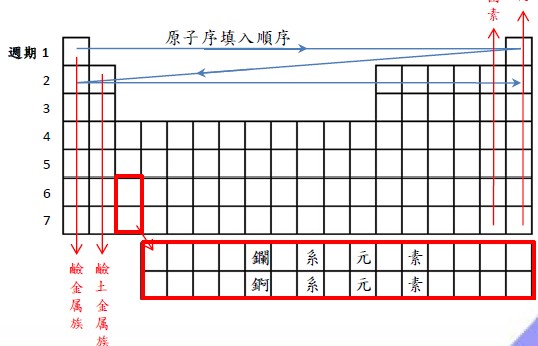
◆ 元素週期表依原子序大小依序排列。
( 備註 : 簡單來說,原子序就是元素在元素週期表的住址 )。
◆ 原子序的排列是依 Z 字形排列。越往下原子序越大。
◆ 元素週期表的週期總共有 7 個。
◆ 元素週期表的族數總共有 18 個。
元素週期表中重要的族
◆ 第 1 族 : 俗稱鹼金屬族,鋰(Li)、鈉(Na)、鉀(K)、銣(Rb)、銫(Cs)、鍅(Fr)。銀白色金屬,活性很大,與氧反應後生成氧化物,而氧化物溶於水後,會放出大量熱量,水溶液呈鹼性(所以叫鹼金屬族)。
◆ 第 2 族 : 俗稱鹼土金屬族,•鈹(Be)、鎂(Mg)、鈣(Ca)、鍶(Sr)、鋇(Ba)、鐳(Ra)。大部分都以化合物存在於地殼中,且其氧化物溶於水也呈鹼性。所以才叫鹼土金屬族。會與碳酸根(CO32-)反應形成白色沉澱物。
◆ 第 17 族 : 俗稱鹵素,氟(F)、氯(Cl)、溴(Br)、碘(I)… 等。鹵素是一類化學性質非常活潑的元素,能和許多金屬形成鹽類。
◆ 第 18 族 : 俗稱惰性氣體,氦(He)、氖(Ne)、氬(Ar)… 等,與其他元素的反應活性非常低。
化學式
化學式的種類
化學式你可以理解成分子(元素跟化合物)的名字,大致上可以分為四類 :
◆ 實驗式(簡式) : 將分子式內的原子數轉換成最簡單整數比。用途最少,因為只能知道『原子種類』跟『原子數的最簡單整數比』。舉例來說 :
葡萄糖的分子式是 C6H12O6,但是轉化成實驗式就變成 CH2O。
◆ 分子式 : 比實驗式好一點,至少可以正確表示分子內實際的『原子種類』跟『原子個數』。但如果以有機化合物來說,它無法顯現出分子的特殊官能基。舉例來說 :
乙醇的分子式是 C2H6O。
◆ 示性式 : 又比分子式好,不但可以正確表示分子內實際的『原子種類』跟『原子個數』,甚至可以顯現出分子的特殊官能基。那顯現特殊官能基可以幹嘛 ? 舉例來說 :
乙醇的分子式是 C2H6O,但如果把它以示性式表示,則變成 C2H5OH,你可以發現到原子種類跟個數沒有改變,但是凸顯出了乙醇的特殊官能基是分子式內帶有 -OH。
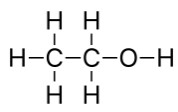
◆ 結構式 : 又比示性式更好,因為可以去理解這個分子內各個原子的排列組合。舉例來說 :
乙醇的結構式
化學式的表示方式
◆ 中文名稱與化學式相反。舉例來說,氯化鈉(食鹽)的分子式是 NaCl。
◆ 有機化合物的分子式必須依照碳(C)、氫(H)、氧(O)的順序。但如果是示性式跟結構式就不用。
常見的離子與根離子
下面這個表格很實用,它基本上就是說明各個元素或原子團喜歡變成的離子狀態,然後藉由陰、陽離子正負相吸引,可以結合成化合物,那… 基本上就把它背起來。

此單元重點如以上所示 !
若有理化問題,歡迎寄信給我!
